治疗前列腺癌的新希望
2011-09-23 11:01:28
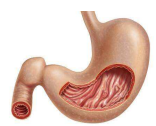
癌症是人类至今没有完全攻克的疾病之一,很多癌症都没有有效的治疗手段,前列腺癌对男性的危害是相当大的,现在人们也开始重视前列腺癌的治疗和研究。80年代,外科手术和放射治疗在前列腺癌治疗方面获得广泛认可。到90年代,黄体生成素释放激素类似物(LHRH-a)和口服抗雄激素制剂问世了,这些内分泌调节药物神奇般地对肿瘤产生了抑制作用。接下来,超过2年的长程内分泌治疗被试验证实有效,但也带来了例如勃起障碍和心肌梗死等严重不良反应。1994年,有关短程雄激素剥夺治疗(ADT,也称去势治疗)的研究表明,对于高分期肿瘤(T2c到T4),4个月的ADT结合放疗使患者获益。现已广泛认可的结论是,对于局部扩散病变(T3 or T4)和高风险局部病变(符合下列一项或多项:PSA>20 ng/ml;Gleason评分8-10分;T2c)两种情况的患者,外照射放疗合并内分泌治疗是前列腺癌的标准治疗方案。
世事多变,PSA(前列腺特异性抗原)的发现改变了前列腺癌的分布格局,早期病例诊断数量增加了。但直到今天,只有一项试验针对中风险局部病变(符合下列一项或多项:10
来自Radiological Associates of Sacremento & RTOG(the Radiation Therapy Oncology Group)的Christopher Jones M.D.和他的同事们报道了一项3期临床试验。放射量66.6Gy的外照射合并4个月的ADT是否比单纯放疗更好?1994年到2001年,他们在1979名男人中寻找着答案。这些人平均年龄71岁,都是前列腺癌局部病变低分期患者(T1b,T1c,T2a,T2b),PSA均<=20ng/ml,其中高、中、低风险比例分别占11%、54%、35%。随机分配后,有992人采用单纯放疗,其余987人采用合并治疗,即在放疗前2个月开始为期4个月的ADT,包括氟他胺250mg tid加每月一次亮脯利特7.5mg肌注或加每月一次戈舍瑞林3.6mg皮下注射。研究以总存活率为主要终点指标,因前列腺癌病死率、远处转移、PSA升高和前列腺2年后重复活检阳性发现等为次要终点指标。
最终随访的主要结果是:10年生存率62%对57%,合并治疗组胜出并存在显著差异。次要指标中,因前列腺癌病死率由8%下降为4%,其余三项次要指标也都存在显著差异。
而风险分层比较中,只有中风险组存在显著差异(61%对54%);因前列腺癌病死率从10%下降至3%。低风险组的主要终点指标没有差别,但合并治疗的确降低了PSA和活检的阳性发现;低风险组的10年因前列腺癌病死率仅有1%,再降还能降到哪儿去呢?
急慢性放疗副作用(主要对于消化系统和泌尿生殖系统)组间无差异。
内分泌治疗对人体代谢平衡的不良反应如约而至。伴随着生存率的小幅上升,合并治疗组较严重的激素相关副作用(3级或以上肝毒性、胃肠道毒性等)发生率小于5%,其他常见不良反应有勃起障碍(1年后比例有所上升,但组间差异不显著)、潮红(55%)、皮疹(3%)等。去年,FDA甚至要求厂商在GnRH(促性腺激素释放激素)激动剂药品上增加这么个标签:警告!此药物可导致糖尿病、心脏病、中风和猝死。虽然可能性很小,但类似报道却有增加趋势。以上这些让我们总结出一个合理的结论,即低风险病变患者不宜使用内分泌治疗。
后话 本次试验中,高风险组也没有获益,但11%比例的基数太小了,说服力不高;4个月的内分泌治疗是否合理,也是一个问题;就算对于成功获益的中风险组,放射量的增加和内分泌治疗时间的增加是否能降低死亡率,Jones同样不知道。对于以上这些缺陷,我们能找到其他的试验作为补充:比如有试验证实6个月的内分泌治疗对于高风险病变是很必要的;有试验证实74Gy比64Gy的照射量提高了患者的生存率;那到底是4个月还是6个月好?尚不得而知。
十几年过去了,适形调强放疗、强度制导放疗、高剂量率和低剂量率内照射等新技术使得现在的放疗比Jones开始试验时安全了许多,允许更高强度的照射。新的放疗技术给这项研究带来了新的问题:中风险病人还必要使用短程ADT吗?还是新式放疗已足够了呢?RTOG再次上马,开始新的征途,我们拭目以待,总之,一项新的治疗技术的问世肯定是会对一些疾病的治疗是有帮助的,它带来了患者的希望,带来了患者的幸福!
本文部分内容来源于网络,如涉及版权问题请立即与微微健康网联系。